膀胱癌已成为全球公共卫生领域的重大挑战,现有诊断手段的局限性严重制约了早期干预效果。膀胱癌诊断中,膀胱镜检查虽为金标准但具侵入性,且超 55% 患者确诊时已处晚期。血清和尿液是潜在诊断样本源,但蛋白质组数据存在异质性、复杂度高及覆盖深度有限等问题,传统机器学习难以有效整合多源数据,亟需新方法提升诊断准确性。
近日,中国科学院杭州医学研究所刘远研究员团队在期刊《ACS Nano》发表题为“Nanoparticle–Protein Corona Boosted Cancer Diagnosis with Proteomic Transfer Learning”的研究。团队首次将纳米蛋白组学技术应用于尿液样本,联合血清蛋白组学,在蛋白质组迁移学习算法(ProteoTransNet)的助力下,膀胱癌临床样本诊断AUC达到了99.6%。这项技术不仅避免了传统膀胱镜的侵入性痛苦,更为癌症早筛提供了全新范式。
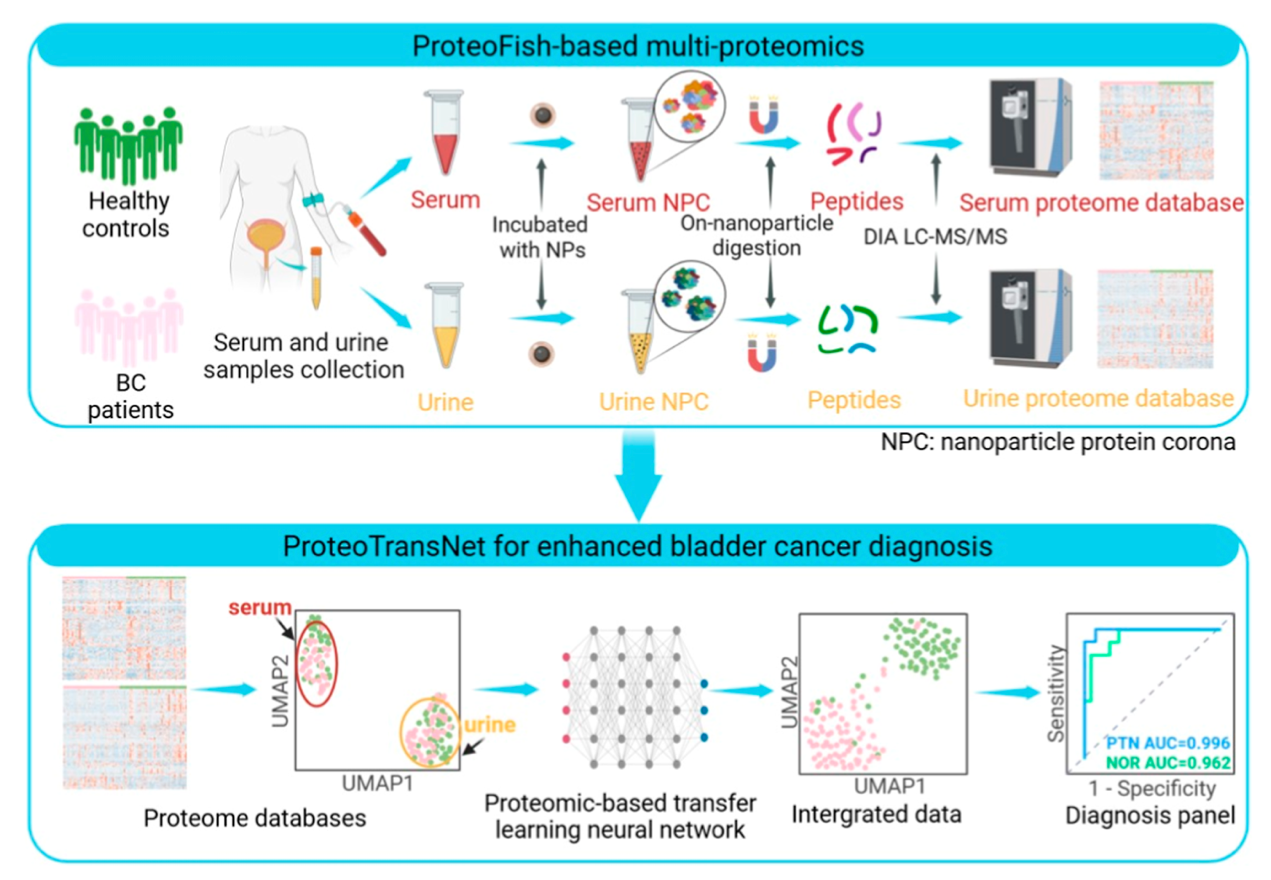
研究者首次将 ProteoFish 纳米技术拓展至尿液,用 Fe₃O₄@SiO₂纳米颗粒形成尿液蛋白质冠(UPC),结合血清蛋白质冠(SPC),构建含 956 种血清蛋白和 4730 种尿蛋白的配对蛋白质组数据库。开发 ProteoTransNet 迁移学习神经网络,整合血清与尿液蛋白质组数据,通过随机森林筛选关键蛋白组,实现膀胱癌诊断与分期分类,还验证其对非肌层浸润性膀胱癌(NMIBC)和肌层浸润性膀胱癌(MIBC)的分类效果。ProteoTransNet 整合数据后,诊断 AUC 达 0.996,分期分类 AUC 为 0.914,显著优于传统方法;独立队列验证中,标签转移准确率 0.9655,F1 分数 0.9643,10 种关键蛋白诊断准确率 0.899。UPC 较传统尿蛋白沉淀法提升 55.5% 蛋白质组覆盖深度,且更稳定。
这项研究通过技术创新与方法突破,构建了膀胱癌诊断的全新体系:UPC 技术解决了尿液蛋白质组深度不足的问题,ProteoTransNet 模型实现了血清与尿液数据的高效整合,最终达成 0.996 的诊断 AUC。
未来,首先可扩大临床样本量,克服当前配对血清和尿液样本收集难度大、数量有限的问题,进一步验证模型普适性与可靠性。其次,可整合组织蛋白质组等更多维度数据,结合膀胱癌病理机制,挖掘更全面的疾病相关生物标志物,提升诊断与预后评估的精准度。此外,ProteoTransNet 的核心逻辑可推广至基因组、转录组等其他组学数据整合,也可应用于其他癌症类型,探索其在多癌种诊断、治疗方案制定及疗效监测中的潜力,为精准医学领域提供更高效的多组学整合工具与研究思路。
附件下载:
