蛋白质合成是细胞功能的核心环节。虽然61个密码子编码20种氨基酸,但细胞在翻译过程中会偏好使用某些同义密码子,这一现象称为密码子偏好。癌细胞会利用这一特点,通过调整转运 RNA(tRNA)库来优先合成对生长和存活至关重要的蛋白质,从而在缺氧、营养不足及药物压力下保持活性,并产生耐药性。不过,目前尚不清楚翻译机器如何实现偏好密码子翻译并提升关键促瘤蛋白的表达,尤其是在肿瘤干细胞中,其机制仍有待深入研究。
近日,美国希望之城(City of Hope)陈建军教授、邓晓岚副教授团队、芝加哥大学何川教授团队与中国科学院杭州医学研究所沈超研究员合作,在《Cancer Discovery》在线发表研究成果,揭示了RNA修饰调控蛋白ALKBH1在急性髓性白血病(AML)中的重要功能和作用机制,并提出潜在的全新治疗策略。

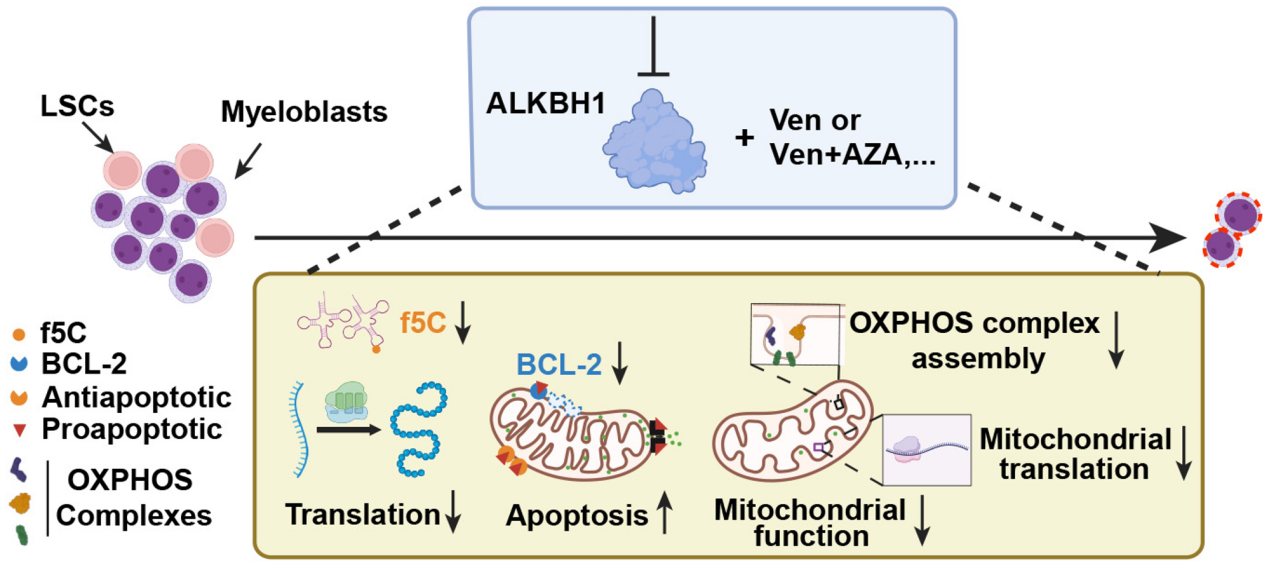
研究团队发现,ALKBH1在AML中显著高表达,尤其在白血病干细胞(LSCs/LICs)中,而在正常造血干细胞中表达相对较低。敲低ALKBH1会显著抑制白血病细胞的生存、线粒体功能以及LSCs/LICs的自我更新,并在动物模型中延缓AML进展,而对正常造血系统影响甚微。
机制研究显示,ALKBH1 可催化tRNA反密码子wobble位点5-甲基胞嘧啶(m5C/m5Cm)转化为5-甲酰胞嘧啶(f5C),从而拓展tRNA的解码能力,使其能够识别更多高频偏好密码子,从而优先翻译富含这些密码子的mRNA。这一快速调整翻译效率和偏好性的机制,被研究团队形象地称为“表观遗传翻译组学的点石成金效应”(Epitranslatomic Midas touch)。
通过整合转录组测序、核糖体测序和蛋白质组测序分析,团队鉴定出多个依赖f5C偏好密码子的翻译靶标,其中核糖体装配因子WDR43尤为关键。ALKBH1缺失会降低 WDR43 表达水平,导致蛋白翻译抑制、线粒体功能受损,并下调抗凋亡蛋白BCL2的表达,从而影响AML细胞的存活能力。抑制ALKBH1或WDR43能显著提高AML细胞对BCL2抑制剂venetoclax的敏感性(提升10–50倍),甚至使耐药细胞恢复敏感。
最后在AML小鼠模型中,靶向ALKBH1联合venetoclax或venetoclax+阿扎胞苷(AZA)能够强效抑制白血病进展,显著延长AML小鼠生存时间,同时对正常造血系统无明显损伤。由于ALKBH1在正常造血系统中并非必需,靶向ALKBH1的药物有望与现有疗法联合,提升疗效、降低毒副作用,为AML及其他ALKBH1高表达肿瘤的治疗提供新方向。
希望之城系统生物学系陈建军教授、邓晓岚副教授,以及芝加哥大学化学系何川教授为论文的共同通讯作者。中国科学院杭州医学研究所的沈超研究员为论文的第一作者兼共同通讯作者。
附件下载:
