中国科学院杭州医学研究所胡海教授联合团队通过系统研究,首次阐明了乳腺癌微环境中恶性细胞与免疫细胞通过精氨酸代谢协作促进免疫逃逸的分子机制,为靶向代谢的联合免疫治疗提供了新思路。
肿瘤微环境作为包含异质性细胞群体的复杂生态系统,其代谢交互网络对疾病进程具有重要调控作用。研究团队采用单细胞测序联合代谢组分析技术,发现乳腺癌细胞通过主动分泌精氨酸,诱导肿瘤相关巨噬细胞(TAM)发生代谢重编程。这种代谢协作促使 TAM 内多胺合成通路异常活化,特别是精胺的过量生成通过表观遗传调控机制,驱动巨噬细胞向免疫抑制表型转化。
研究发现,临床乳腺癌患者血清精氨酸水平与肿瘤进展呈显著正相关,但该促癌效应严格依赖于完整免疫系统的存在。在免疫缺陷模型中,外源补充精氨酸未能显著加速肿瘤生长,这提示其促癌作用主要通过免疫调控途径实现。
机制研究进一步发现,巨噬细胞内精胺的异常积累通过调控 DNA 去甲基化酶活性,重塑关键免疫调控基因的表观遗传。这种表观重编程促使 TAM 分泌免疫抑制因子,显著抑制 CD8+ T 细胞的活化与功能。而采用 FDA 批准的多胺合成抑制剂 DFMO 阻断该代谢轴,可有效逆转免疫抑制微环境,抑制肿瘤进展。
该研究首次揭示了介导精氨酸促癌功能的主要细胞间协作,不仅解释了既往研究中精氨酸功能异质性的争议,也为相关提供了新的思路。研究团队证实,靶向干预肿瘤细胞-TAM 间的精氨酸-多胺代谢轴,可有效增强现有免疫治疗的应答效率。目前,基于该发现的临床试验正在积极筹备中。
2025 年 4 月 3 日,相关肿瘤代谢调控的最新研究成果以Cancer cell-derived arginine fuels polyamine biosynthesis in tumor-associated macrophages to promote immune evasion为题, 在线发表在国际权威期刊 Cancer Cell上。据悉,这项历时五年的系统性研究整合了细胞模型、小鼠模型及临床队列等多维度证据链。通讯作者胡海教授表示,该成果标志着肿瘤代谢研究从单一细胞类型分析向微环境整体网络解析的重要转变,为开发「代谢微环境重塑」治疗策略奠定了理论基础。
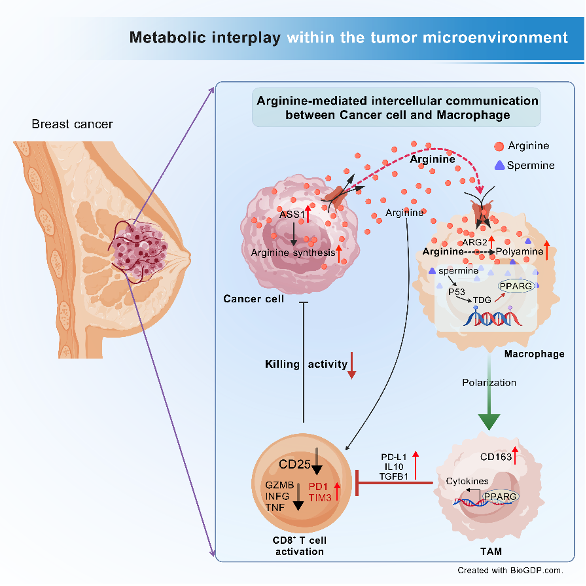
图 1. 乳腺癌细胞与 TAM 间通过精氨酸代谢交互促进肿瘤发展的机制图
附件下载:
