在每一个细胞分裂周期中,DNA复制与转录必须在同一片基因组上“和平共处”。DNA复制需要高速推进,以完成约30亿个碱基对的复制;而转录则需精密调控,以维持细胞命运相关基因的正常表达。然而,这两项基本过程常常在基因组上“狭路相逢”。特别是在转录活跃区域,复制叉需要穿越正在被转录的基因区域,尤其是当复制体与RNA聚合酶II(RNA Pol II)复合物共用同一DNA模板时,便容易发生所谓的转录–复制冲突(transcription-replication conflicts, TRCs)。
传统上, TRCs按其方向性分为迎头(head-on)和同向(co-directional)两类。由于方向相反,head-on 碰撞被认为是复制压力的主要来源;而方向一致的 co-directional 碰撞则长期被视为影响较小的“擦肩而过”。这一观点曾受到体外实验和数学建模的支持,认为复制叉能够被动绕过转录复合物,因而危害有限。然而,越来越多的证据显示,co-directional TRCs 并非罕见事件,而是在哺乳动物细胞中普遍存在,其发生频率远超过 head-on TRCs,特别是在长基因、高表达基因及具有特定染色质修饰的区域中尤为显著。这些被视为“友好” 的同向碰撞,实则是一颗隐藏于基因组稳定性之下的 “定时炸弹” ——它们不仅可能阻滞复制进程,还能诱发DNA损伤断裂,甚至导致染色体重排。这些发现引出了一个关键问题:面对这种高频且有害的冲突,细胞如何演化出精确的分子机制,以识别并应对,从而维持基因组的稳定?
2025年10月8日,中国科学院杭州医学研究所黄金舟团队联合美国Mayo Clinic楼振昆团队在Nature发表题为:KCTD10 is a sensor for co-directional transcription-replication conflicts的突破性研究,首次揭示一类称为CUL3–KCTD10的泛素连接酶复合物,能够像 “分子传感器” 一样精确检测同向转录-复制冲突,并通过泛素信号调控机制协助复制体顺利通过,避免DNA损伤和基因组不稳定。

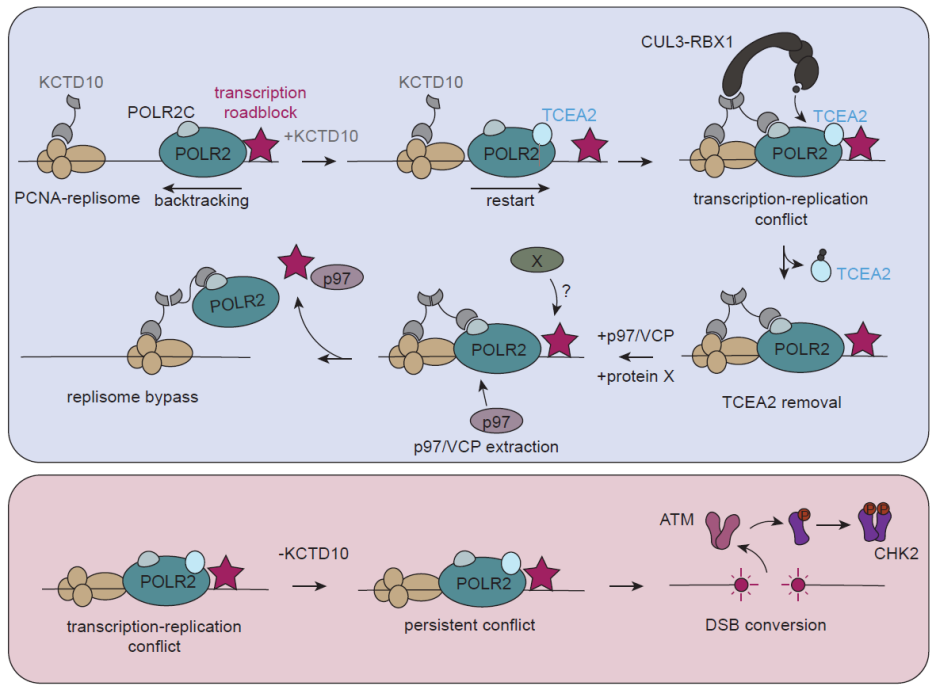
研究团队发现KCTD10蛋白是一个关键的“精巧探测器”。KCTD10 通过其 C 端的 PIP-Box,在 DNA 复制过程中稳定结合复制因子 PCNA。发生同向转录-复制冲突时,该蛋白可同时识别复制机器 PCNA 与转录机器 RNA Pol II 的 “尾部” ,在二者之间发挥桥接作用,协调冲突应答。KCTD10 这种双价结合的特性,确保其仅在复制与转录机器 “同向相撞” 的位点被激活,从而实现对冲突位点的高度特异性识别。在冲突位点,KCTD10会发生二聚化/寡聚化(关键氨基酸R167不可或缺),形成一个平台来招募CUL3蛋白,组成有活性的CUL3-KCTD10 E3泛素连接酶复合物。这种自组装能力对于其功能至关重要,突变体实验表明,失去自组装能力的KCTD10无法解决co-directional TRCs。令人惊讶的是,该复合物并不靶向RNA Pol II 的核心亚基,而是选择性地泛素化转录延伸因子 TCEA2(TFIIS 家族成员)。这一修饰抑制了 RNA Pol II 的转录重启,进而促使其复合体结构发生重塑,降低其与 DNA 的亲和力,从而 “腾出空间” ,使复制机器得以顺利通过冲突区域。
这项工作彻底改变了人们对同向TRCs的看法:它们不再是“无害的擦肩而过”,而是需要精细调控的基因组维护节点。同时,研究也拓展了对泛素化功能的理解——它不仅标记降解,还能作为“分子扳手”调节大分子复合物的构象和功能。该通路的发现具有重要的临床意义:1,KCTD10缺陷可能导致肿瘤基因组更不稳定,为复制压力相关疾病提供了新的治疗靶点开发思路。2,KCTD10缺陷细胞对CHK2抑制剂非常敏感,提示联合治疗潜力。
总的来说,这项研究不仅揭示了细胞解决转录-复制冲突的新机制,更展示了一种精巧的分子调控策略:KCTD10就像一位高效的“分子交警”,在复制叉与转录复合体即将相撞的瞬间精准出手,通过泛素化“舒缓交通”,保障基因组信息传递的准确性和完整性。
附件下载:
