靶向药物递送策略能选择性地将细胞毒性药物递送至肿瘤细胞实现精准杀伤,在增强疗效的同时显著降低系统性毒副作用,克服了化放疗等传统癌症治疗方法肿瘤特异性不足的局限性。抗体-药物偶联物(ADC)是当前肿瘤学领域发展最快的治疗方式之一,已有19种ADC获FDA批准上市,另有超过百种ADC正处于临床试验阶段。作为下一代靶向抗癌药物,多肽-药物偶联物(PDC)也受到广泛关注。除了抗体和多肽,核酸适体作为一类独特的靶向配体,凭借其易于合成和修饰、免疫原性低、化学稳定性好以及组织渗透快等优势,使得核酸适体-药物偶联物(ApDC)成为癌症靶向治疗领域中一种颇具吸引力的策略。尽管在之前的临床前研究中,ApDC已展现出良好的肿瘤靶向能力和抗肿瘤效果,但其临床转化仍然面临疗效不足和系统性药代动力学(PK)、毒代动力学(TK)及安全性评价缺失等挑战。
近日,中国科学院杭州医学研究所联合中国科学院杭州医学研究所附属肿瘤医院(浙江省肿瘤医院)、湖南大学、上海交通大学及其附属仁济医院,在《Signal Transduction and Targeted Therapy》期刊上发表了题为“An aptamer-drug conjugate for promising cancer therapy with comprehensive evaluation from rodents to non-human primates”的一项重要研究成果。研究团队成功开发出一款靶向蛋白酪氨酸激酶7(PTK7)的核酸适体-药物偶联物(ApDC) Sgc8c-M,并在从啮齿类动物至非人灵长类动物的多层次模型中,系统评估了其抗肿瘤效果、药代动力学与毒代动力学特性以及安全性,为阐明ApDC药物特性及推动其临床转化奠定了重要基础。

PTK7在多种恶性肿瘤中过表达,其过表达通常与预后不良、肿瘤转移和总生存期不足相关。由于PTK7缺乏催化活性,难以针对该靶点开发小分子抑制剂。近年来,多种靶向PTK7的ADC药物,如h6M24-vc0101和MTX-13,已展现出令人鼓舞的抗肿瘤疗效并进入临床研究阶段。这些进展突显了以PTK7为靶点开发ApDC药物的临床转化潜力。研究团队采用一步迈克尔加成反应,通过组织蛋白酶B (CTSB)可切割的缬氨酸-瓜氨酸(VC)二肽连接子将PTK7特异性的核酸适体Sgc8c与强效抗有丝分裂剂单甲基澳瑞他汀E(MMAE)进行高效偶联,成功构建了ApDC药物Sgc8c-M。该合成策略简便高效,具备良好的规模化生产潜力。在靶向性方面,Sgc8c-M在体内外均展现出优异的靶向能力,能够以高亲和力与小鼠、大鼠、食蟹猴和人源PTK7蛋白结合。这一跨物种识别特性提示Sgc8c-M的效力可能维持一致,增强了临床前评估的转化相关性。
在多种PTK7过表达的癌症模型(包括三阴性乳腺癌、胰腺癌、结直肠癌、非小细胞肺癌和卵巢癌模型)中,Sgc8c-M均显示出强大的肿瘤抑制效果,可有效诱导细胞系来源异种移植瘤(CDX)和人源肿瘤异种移植瘤(PDX)的持续消退,其疗效显著优于游离MMAE、化疗药物紫杉醇以及负载相同MMAE药物的PTK7 ADC。
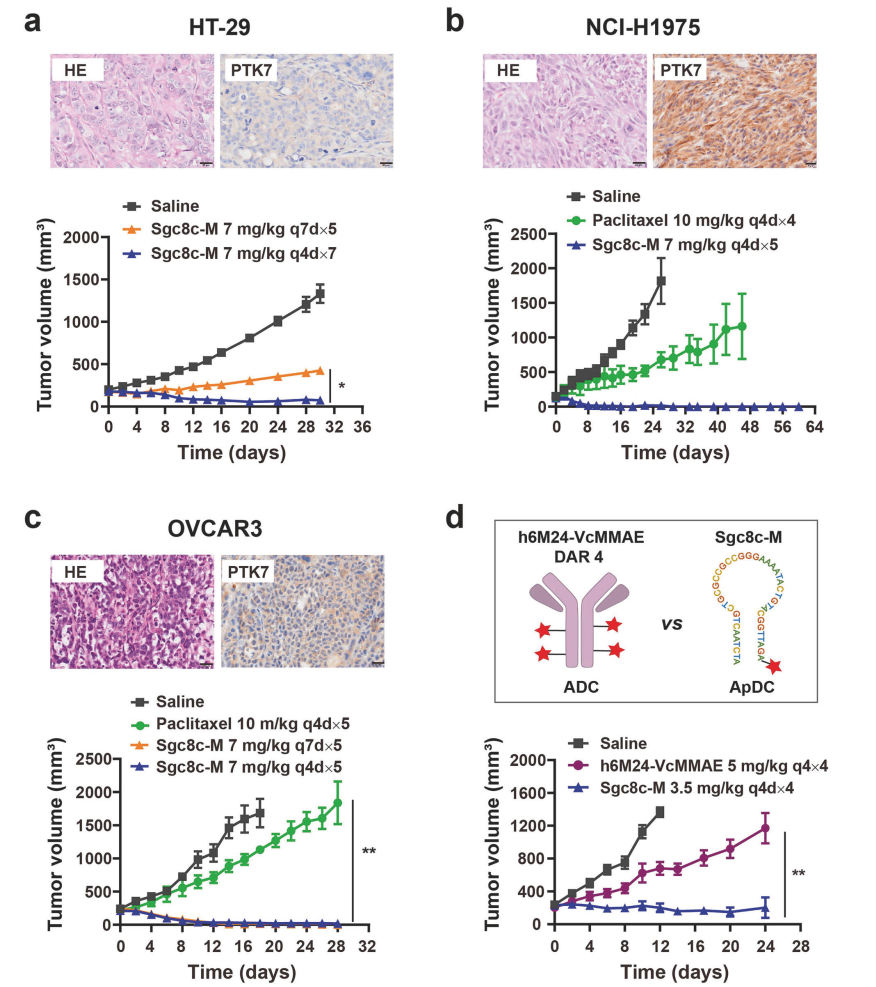
图1:Sgc8c-M在HT-29结直肠癌、NCI-H1975非小细胞肺癌和OVCAR3卵巢癌模型中的抗肿瘤作用研究。
小鼠模型中的药代动力学(PK)研究显示,Sgc8c-M能快速在肿瘤组织中富集并维持持续的MMAE水平,同时在血浆和正常组织中被迅速清除。大鼠模型中的研究进一步验证该药物在多数器官中的快速清除特性,约75%的MMAE在24 h内通过尿液和粪便排泄。毒代动力学(TK)评估结果表明,重复给药后的全身药物暴露量与单次给药相当,未出现药物蓄积。毒性评价显示,Sgc8c-M在高疗效剂量下安全性良好,即使在极高剂量下所引发的毒性反应亦可逆转。在食蟹猴模型中,Sgc8c-M的PK/TK特征与大鼠模型一致,展现出良好的剂量依赖性药物暴露,且在多次给药后未见明显药物蓄积。Sgc8c-M在食蟹猴中展现了良好的安全性和耐受性,其治疗窗口(7 - 14)明显宽于靶向PTK7的ADC药物h6M24-vc0101(治疗窗口为3 - 5)。
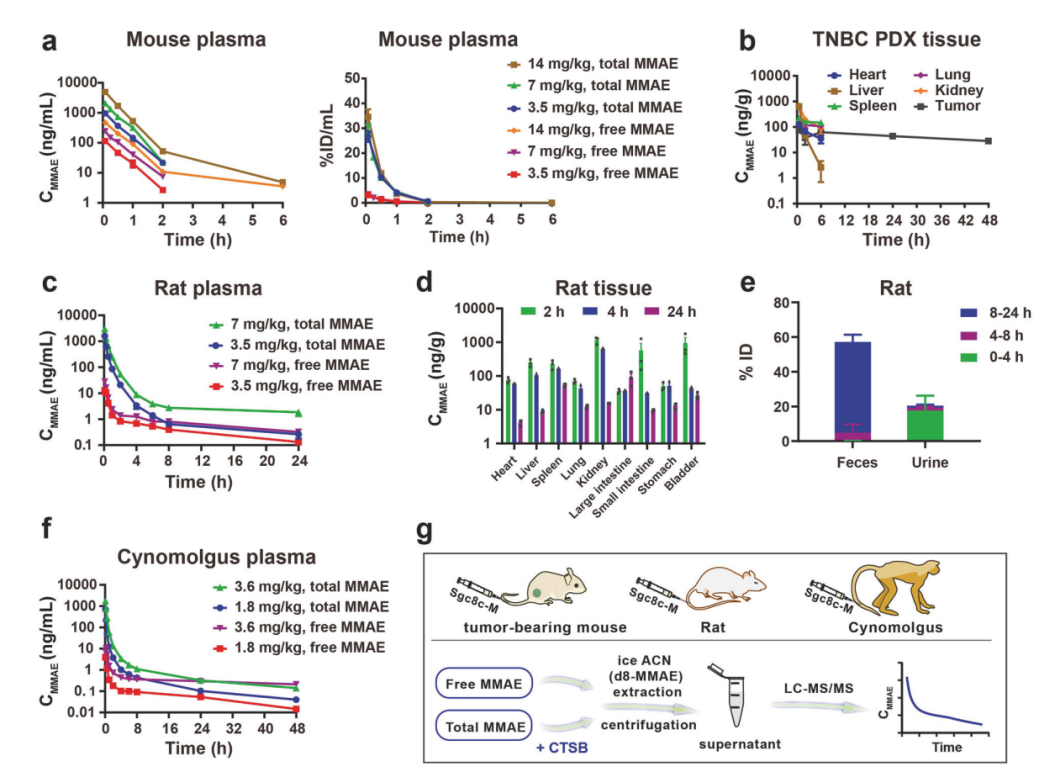
图2:Sgc8c-M在小鼠、大鼠和食蟹猴中的药代动力学(PK)研究。
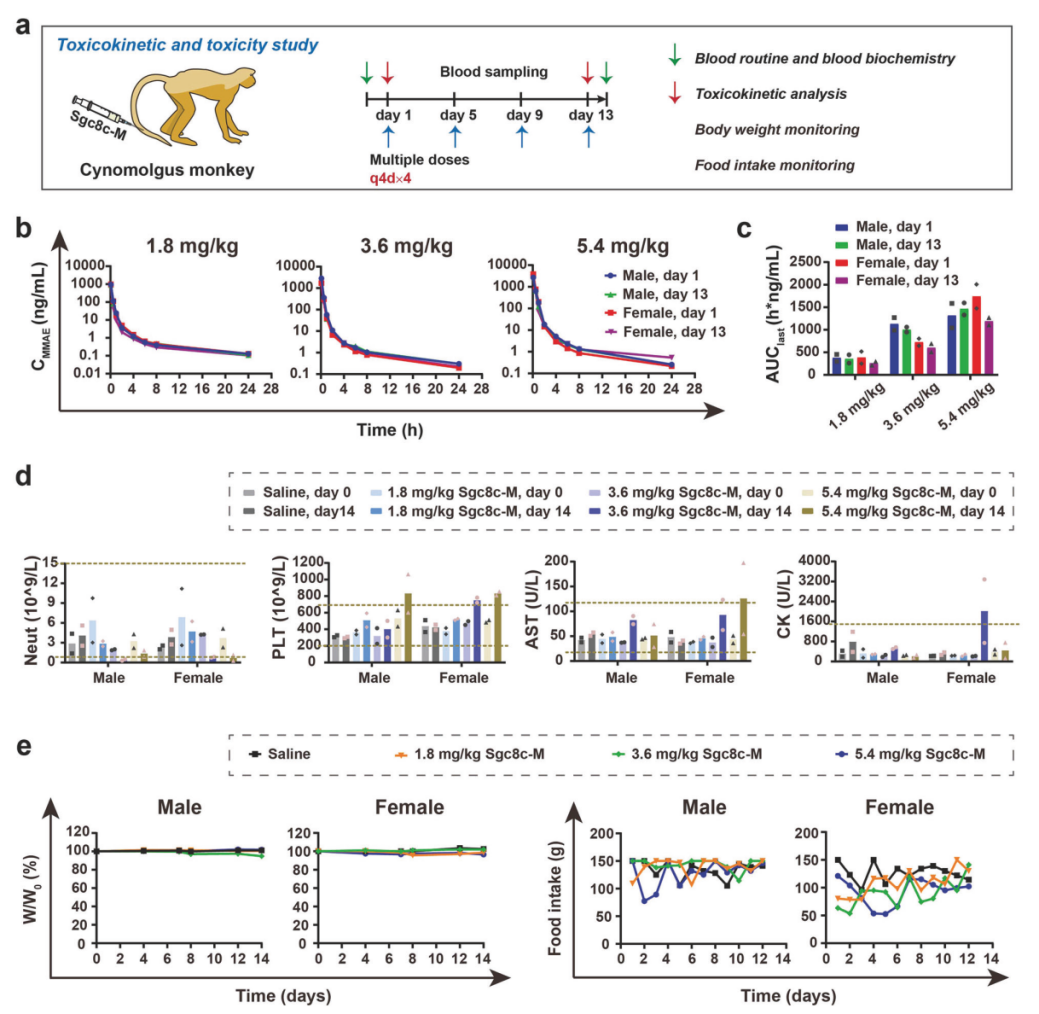
图3:Sgc8c-M在食蟹猴中的重复剂量给药毒代动力学(TK)与毒性研究。
该研究首次对一款ApDC药物完成了从分子构建、药效验证到啮齿类及非人灵长类安全评价的系统临床前研究。Sgc8c-M在临床前研究中展现出显著的抗肿瘤疗效、优异的药代动力学与毒代动力学特性,并在非人灵长类动物食蟹猴上显示出扩宽的治疗窗口和卓越的安全性。该研究不仅揭示了Sgc8c-M作为PTK7阳性实体瘤治疗策略的临床转化潜力,也为ApDC领域的后续临床转化工作奠定了重要的研究基础。
附件下载:
